La teoría moderna supone que el núcleo del átomo está rodeado por una nube tenue de electrones que retiene el concepto de niveles estacionarios de energía, pero a diferencia del modelo de Bohr, no le atribuye al electrón trayectorias definidas, sino que describe su Idealización en términos de probabilidad.
A partir de esta interpretación se estableció el concepto de orbital atómico, que puede expresarse así:
"Orbital atómico es la zona alrededor del núcleo donde existe la mayor probabilidad de encontrar al electrón".
Esta teoría deriva de tres
conceptos fundamentales:
- Concepto de estados estacionarios de energía del electrón propuesto por Bohr.
Normalmente los electrones se encuentran en el nivel de mínima energía (estado basal o fundamental), pero pueden absorber energía, pasando a un nivel superior, más alejado del núcleo (estado excitado); este estado es inestable y al regresar el electrón a su nivel original emite la energía absorbida en forma de radiación electromagnética.
Mientras los electrones describen una órbita, no hay absorción ni emisión de energía.
- Naturaleza dual de la masa sugerida por Luis De Broglie.
Las partículas muy pequeñas que se desplazan a alta velocidad (como es el caso de los electrones) tienen la propiedad de comportarse, en ocasiones como corpúsculos materiales y, en otros fenómenos, como ondas (dualidad onda-partícula).
 |
| Imagen ilustrativa de la dualidad onda-partícula, en la cual se puede ver cómo un mismo fenómeno puede tener dos percepciones distintas. |
- Principio de incertidumbre de Heisenberg.
Werner Heisenberg presentó el principio de incertidumbre como una consecuencia de la
dualidad de la naturaleza del electrón.
Heisenberg refiriéndose a la
colisión entre un fotón y un electrón, postuló que, debido a que ambos cambian
su posición y su velocidad, es imposible en un momento dado establecer la
posición y velocidad del electrón en un nivel energético.
Fue así como Schrödinger,
después de sopesar las ideas de Bohr y de De Broglie,
y tratando de aunar ambas, dedujo una ecuación matemática en la que el electrón
era tratado en función de su comportamiento ondulatorio.
De acuerdo con la ecuación
de onda de Schrödinger,
la posición probable de un electrón está determinada por cuatro parámetros
llamados cuánticos, los cuales tienen valores dependientes entre sí.
Forma y el número de orbitales de cada nivel
El concepto de orbital es
abstracto, es una función de ondas de la cual deriva una ecuación de
probabilidades.
Sin embargo, es útil lograr
una representación física que sea lo más fiel posible al modelo matemático.
La forma de los orbitales
depende del subnivel que ocupa el electrón.
Los orbitales de los
subniveles s tienen forma esférica. Esto implica que la probabilidad de
encontrar al electrón es igual en todas las direcciones a partir del núcleo y
solo depende de la distancia al mismo. En cada subnivel s hay un solo
orbital s.
El núcleo del átomo está en
el centro de la esfera, en la intersección de los ejes x, y, z
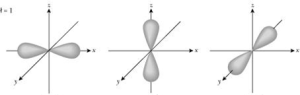
Los orbitales de los
subniveles p no presentan simetría esférica. La probabilidad de
encontrar al electrón no solo depende de la distancia al núcleo, sino también
de la dirección que se sigue.
De acuerdo con el cálculo
de probabilidades, se considera que un orbital p está formado por dos
esferas difusas a ambos lados del núcleo.
En cada subnivel p hay tres orbitales p que suelen llamarse px, py y pz, los cuales son perpendiculares entre si y se hallan orientados hacia los tres ejes x, y, z de un sistema cuyo origen está en el núcleo.







No hay comentarios.:
Publicar un comentario